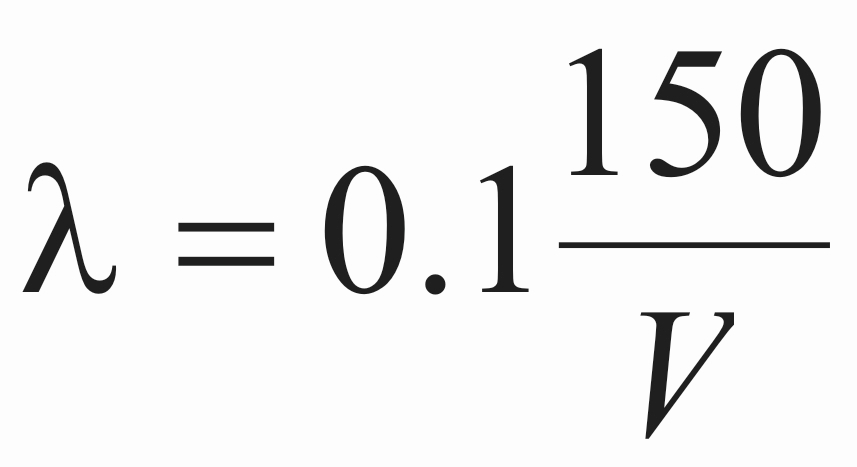 (1)
(1)Κωνσταντίνος Φασσέας, Καθηγητής Γ.Π.Α.
Ο όρος Ηλεκτρονικό Μικροσκόπιο, αν και λανθασμένος, έχει επικρατήσει στην Ελληνική ορολογία. Πιο σωστά θα έπρεπε να ονομάζεται Ηλεκτρονιακό Μικροσκόπιο επειδή η ακτινοβολία που χρησιμοποιεί είναι επιταχυνμένα ηλεκτρόνια. Η λέξη ηλεκτρονικό, όπως έχει επικρατήσει στην Ελληνική γλώσσα, σημαίνει απλά ότι είναι μια ηλεκτρονική συσκευή. Ο αντίστοιχος Αγγλικός όρος είναι Electron Microscope και όχι Electronic όπως λάθος πολλοί το αναφέρουν. Στη Γαλλική γλώσσα ο όρος είναι ο ίδιος, και για τις δυο έννοιες και μάλλον από αυτή προήλθε και ο αντίστοιχος Ελληνικός.
Σύμφωνα με τη θεωρία του De Broglie, το μήκος κύματος λ των ηλεκτρονίων υπολογίζεται από τον τύπο:
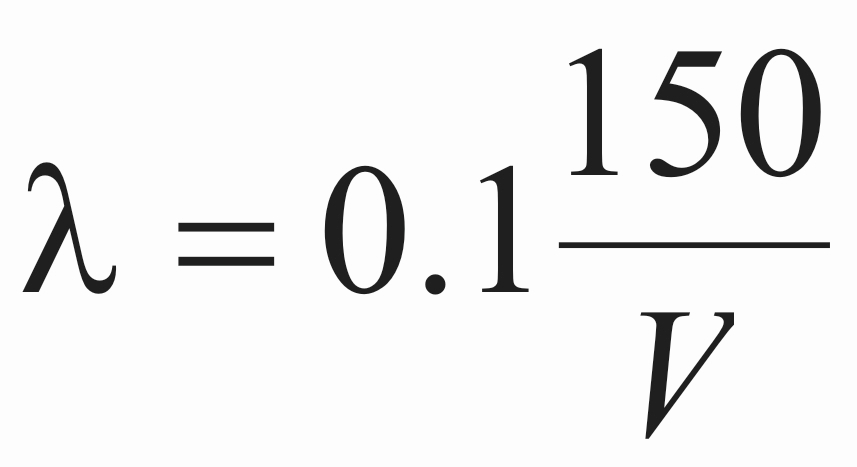 (1)
(1)
όπου V είναι η τάση επιτάχυνσης των σωματιδίων σε Volts και λ το μήκος κύματος των επιταχυνμένων ηλεκτρονίων. Έτσι για μια τάση επιτάχυνσης 80 kV, το μήκος κύματος λ γίνεται λ=0.004 nm.
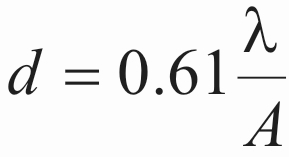
σύμφωνα με τον τύπο (2), όπου (Α) είναι το αριθμητικό άνοιγμα του φακού, η διακριτική ικανότητα (d) γίνεται περίπου 0.15 nm.
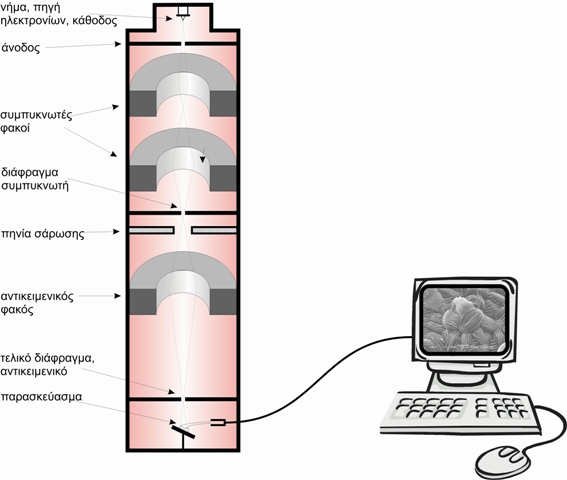
Στο ΗΜΔ (Εικόνα 1), η πηγή ηλεκτρονίων αποτελείται ένα νήμα βολφραμίου (ή ακίδα LaB6) που με την πυράκτωσή, όταν περάσει από αυτό ηλεκτρικό ρεύμα, εκπέμπει ηλεκτρόνια. Μεταξύ του νήματος, που αποτελεί την κάθοδο, και της ανόδου, εφαρμόζεται μια διαφορά δυναμικού (συνήθως της τάξης των 60-100 kV) η οποία επιταχύνει τα ηλεκτρόνια. Η πορεία των ηλεκτρονίων, ρυθμίζεται από τους ηλεκτρομαγνητικούς φακούς στους οποίους αλλάζοντας την ένταση του ρεύματος που τους διαπερνάει, μπορούμε να μεταβάλλουμε την ένταση του μαγνητικού πεδίου τους (δηλαδή την εστιακή τους απόσταση) και επομένως να εστιάσουμε τη δέσμη των ηλεκτρονίων πάνω στο παρασκεύασμα.
Οι κύριες ρυθμίσεις σ' ένα ΗΜΔ επιτυγχάνονται με:
1. τον συγκεντρωτή φακό (condenser lens), εστίαση της δέσμης στο παρασκεύασμα.
2. τον αντικειμενικό φακό (objective lens), εστίαση της εικόνας στην οθόνη.
3. ενδιάμεσος ή και φακός προβολής (intermediate, projector lens) για τη ρύθμιση της μεγέθυνσης.
Η εικόνα σχηματίζεται πάνω σε μια οθόνη επικαλυμμένη με φωσφορίζουσα ουσία η οποία διεγείρεται από τα ηλεκτρόνια που πέφτουν επάνω της, αφού αυτά διαπεράσουν το παρασκεύασμα. Τα σημεία του παρασκευάσματος που δεν είναι διαπερατά από τα ηλεκτρόνια, μας δίνουνσκοτεινές περιοχές (ηλεκτρονιόφιλες, ηλεκτρονιακά πυκνές, electron dense) ενώ αντίθετα τα διαπερατά σημεία (ηλεκτρονιακά διαφανή, electron lucent) μας δίνουν φωτεινές περιοχές. Αυτή η διαφοροποίηση επιτυγχάνεται με την εκλεκτική «χρώση» του παρασκευάσματος
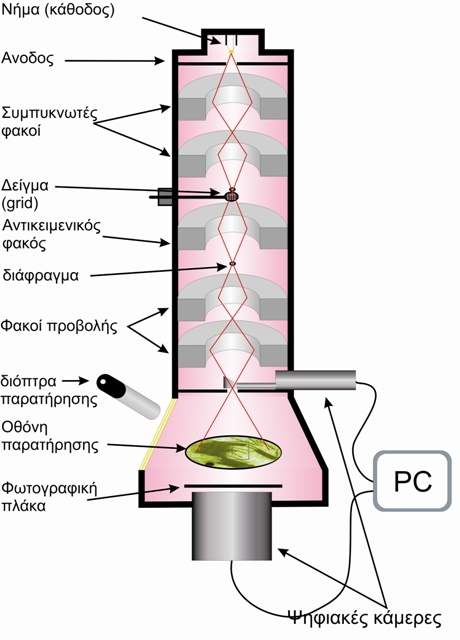
Εικόνα 1. Σχηματική παράσταση ενός ηλεκτρονικού μικροσκοπίου διέλευσης.
Φυσικά αυτές τις εικόνες εκτός του ότι μπορούμε να τις παρατηρήσουμε απ' ευθείας στην οθόνη του μικροσκοπίου, μπορούμε και να τις απεικονίσουμε με τις ειδικές φωτογραφικές μηχανές που είναι πάντα ενσωματωμένες στα μικροσκόπια. Τα πιο σύγχρονα μικροσκόπια διαθέτουν ενσωματωμένη ψηφιακή κάμερα και μικροϋπολογιστή και έτσι μπορεί να γίνει απευθείας ψηφιοποίηση και αποθήκευση της εικόνας
Επειδή τα ηλεκτρόνια δε μπορούν να ταξιδέψουν στον αέρα, το όλο σύστημα, πηγή ηλεκτρονίων, φακοί, παρασκεύασμα, οθόνη και σύστημα φωτογράφησης πρέπει να βρίσκονται σε υψηλό κενό της τάξης των 10-4 Torr τουλάχιστο.
Ο τρόπος που λειτουργεί το ηλεκτρονικό μικροσκόπιο, μας θέτει πολλούς περιορισμούς ως προς τη φύση των δειγμάτων που μπορούμε να παρατηρήσουμε. Έτσι ένα δείγμα για να είναι δυνατό να παρατηρηθεί με το κλασσικό ΗΜΔ και με τις κλασσικές μεθόδους θα πρέπει να έχει τις παρακάτω ιδιότητες:
α. να αντέχει σε υψηλό κενό,
β. να είναι σταθερό στο βομβαρδισμό ηλεκτρονίων,
γ. να είναι αρκετά λεπτό για να μπορούν να το διαπερνούν τα ηλεκτρόνια, και
δ. να επιτρέπει τη διαφορική σκέδαση των ηλεκτρονίων.
Αυτές οι ιδιότητες που πρέπει να έχει ένα παρασκεύασμα, μας περιορίζουν στο να μπορούμε να εξετάσουμε μόνο μονιμοποιημένα δείγματα (νεκρά), αφυδατωμένα, κομμένα σε πολύ λεπτές τομές (πάχος 50-100 nm) και «χρωματισμένα» με «χρωστικές» που περιέχουν βαριά μέταλλα, όπως για παράδειγμα είναι ο μόλυβδος και το ουράνιο.
Ένα βιολογικό δείγμα για να αποκτήσει τις πιο πάνω ιδιότητες θα πρέπει να υποβληθεί στην πιο κάτω διαδικασία:
α. Μονιμοποίηση (στερέωση, καθήλωση, προσήλωση, fixation). Έχει ως σκοπό την ακινητοποίηση (νέκρωση) όλων των διαδικασιών του κυττάρου και μπορεί να επιτευχθεί με χημικούς και φυσικούς τρόπους. Οι χημικοί τρόποι, που είναι και οι πιο συνηθισμένοι) περιλαμβάνουν επεξεργασία του δείγματος με ουσίες όπως οι αλδεΰδες (φορμαλδεΰδη HCHO, παραφορμαλδεΰδη, γλουταρική αλδεΰδη CHOCH2CΗ2CH2CHO και μίγματά τους) ή άλλες ουσίες όπως η ακρολεΐνη CH2CH2CHΟ, το τετροξείδιο του οσμίου OsO4, το υπερμαγγανικό κάλιο KMnO4, κ.ά. διαλυμένα σε κατάλληλα ρυθμιστικά διαλύματα (φωσφορικά, κακοδυλικό νάτριο, veronal acetate, PIPES κλπ.) των οποίων η συγκέντρωση και το pH πρέπει να είναι ρυθμισμένα με μεγάλη ακρίβεια. Οι φυσικοί τρόποι μονιμοποίησης χρησιμοποιούν γρήγορη ψύξη του δείγματος, συνήθως με υγρό Ν2 ή Freon σε θερμοκρασία υγρού Ν2. Αυτές οι μέθοδοι είναι ιδιαίτερα χρήσιμες σε περιπτώσεις όπου χρειάζεται να διατηρηθεί η δραστικότητα ουσιών όπως τα νουκλεϊκά οξέα (DNA, RNA) ή οι πρωτεΐνες (ένζυμα).
β. Αφυδάτωση. Σ' αυτό το στάδιο γίνεται αντικατάσταση του νερού του μονιμοποιημένου δείγματος με αιθυλική αλκοόλη ή ακετόνη και στη συνεχεία με τον ενδιάμεσο διαλύτη 1,2-εποξυπροπάνιο (προπυλενοξείδιο) που είναι διαλύτης των εποξικών ρητινών που χρησιμοποιούνται στο επόμενο στάδιο.
γ. Εμπότιση - έγκλειση. Για να μπορέσει να κοπεί ένα βιολογικό παρασκεύασμα σε λεπτές τομές θα πρέπει το μέσο αφυδάτωσης ν' αντικατασταθεί με το μέσο έγκλεισης που πριν πολυμεριστεί είναι υγρό και στερεοποιείται με πολυμερισμό όταν εκτεθεί σε υψηλή θερμοκρασία (περίπου 70οC) ή υπεριώδη ακτινοβολία. Τα μέσα έγκλεισης είναι συνήθως εποξικές ή άλλες ρητίνες με διάφορα εμπορικά ονόματα όπως Araldite, Spurr, LR-White κ.ά.
δ. Τμήση τομών Τα δείγματα κατόπιν κόβονται σε πολύ λεπτές τομές, πάχους 50-100 nm, με τον υπερμικροτόμο, και τοποθετούνται πάνω σε ειδικά πλέγματα Εικόνα 2, (grids, αντίστοιχα με τις αντικειμενοφόρους πλάκες) που τοποθετούνται στο ΗΜΔ.
ε. Χρώση. Συνήθως τα βιολογικά δείγματα είναι τελείως διαπερατά από τα ηλεκτρόνια γιατί τα στοιχεία από τα οποία αποτελούνται (συνήθως C, H, O και N) είναι πολύ ελαφριά για να σκεδάσουν τα επιταχυνμένα ηλεκτρόνια και να δώσουν την απαιτούμενη αντίθεση (contrast). Για το λόγο αυτό χρειάζεται να τα «χρωματίσουμε» με χημικές ουσίες που δεσμεύονται εκλεκτικά από τα διάφορα συστατικά του κυττάρου, με αποτέλεσμα τη διαφορική σκέδαση των ηλεκτρονίων και το σχηματισμό της εικόνας. Οι πιο συνηθισμένες χρωστικές για τη χρώση τομών είναι το οξικό ουρανύλιο, ο κιτρικός μόλυβδος και το υπερμαγγανικό κάλιο.

Εικόνα 2. Πλέγμα (grid) ηλεκτρονικού μικροσκοπίου τα οποία έχουν διάμετρο 3mm και είναι συνήθως κατασκευασμένα από χαλκό, νικέλιο, χρυσό ή άνθρακα.
Ορισμένες κατηγορίες κυττάρων, μικροοργανισμών ή μεγαλομορίων των οποίων δε μας ενδιαφέρει άμεσα η εσωτερική τους δομή (βακτήρια, ιοί, πρωτεϊνικά μόρια, νουκλεϊκά οξέα κλπ.) μπορούν να παρατηρηθούν με το ΗΜΔ με αρνητική χρώση. Με αυτή τη μέθοδο συνήθως το παρασκεύασμα δε χρειάζεται να μονιμοποιηθεί, παρά μόνο να τοποθετηθεί και απλωθεί πάνω στα πλέγματα (grids) που είναι καλυμμένα με μια πολύ λεπτή μεμβράνη, από πλαστικό ή άνθρακα. Στη συνέχεια γίνεται η χρώση με ένα διάλυμα που περιέχει ένα βαρύ μέταλλο, όπως για παράδειγμα το φωσφοβολφραμικό οξύ (PTA), το μολυβδαινικό αμμώνιο, το οξικό ουρανύλιο, η βολφραμική μεθυλαμίνη, το μυρμηκικό ουρανύλιο ή συνδυασμούς τους. Η μέθοδος αυτή είναι πολύ απλή και γρήγορη και ιδιαίτερα χρήσιμη στη διάγνωση ιώσεων φυτών και ζώων. Η μέθοδος αυτή μπορεί να χρησιμοποιηθεί σε συνδυασμό και με άλλες ιστοχημικές ή ανοσοβιολογικές μεθόδους.
Το ΗΜΣ παράγει καλά εστιασμένες τρισδιάστατες εικόνες με μεγάλη λεπτομέρεια. Ένα σύγχρονο ΗΜΣ έχει διακριτική ικανότητα που φτάνει τα 3 nm. Το ΗΜΣ χρησιμοποιεί, όπως και το ΗΜΔ, μια δέσμη ηλεκτρονίων που εδώ όμως αντί να διαπερνούν το παρασκεύασμα, σαρώνουν την επιφάνειά του (όπως σαρώνουν τα μάτια μας τη σελίδα ενός βιβλίου όταν διαβάζουμε) με πολύ μεγάλη ταχύτητα. Η δέσμη των ηλεκτρονίων παράγεται και εδώ από ένα νήμα, και ένα σύστημα ανόδου καθόδου όπου εφαρμόζεται υψηλή τάση, συνήθως της τάξης των 15-40 kV, για την επιτάχυνση των ηλεκτρονίων Η δέσμη των ηλεκτρονίων αφού εστιαστεί από σύστημα συγκεντρωτών φακών βομβαρδίζει το παρασκεύασμα με αποτέλεσμα κάποια από τα ηλεκτρόνια να το διαπερνούν, κάποια να σκεδάζονται ή να άγονται ενώ συγχρόνως να προκαλείται η παραγωγή δευτερογενών ηλεκτρονίων, ακτινών Χ και ηλεκτρονίων Auger, όπως δείχνει η Εικόνα 4. Τα δευτερογενή ηλεκτρόνια, που προέρχονται από την επιφάνεια του παρασκευάσματος έχουν μικρή σχετικά ενέργεια που σχετίζεται με τη τοπογραφία του. Αυτά τα δευτερογενή ηλεκτρόνια συλλέγονται και στέλνονται σαν ένα ηλεκτρονικό σήμα μέσω ενός ενισχυτή εικόνας σ’ ένα καθοδικό σωλήνα (CRT) όπου γίνεται και η παρατήρηση ή και η φωτογράφηση του δείγματος. Στα σύγχρονα ΗΜΣ το αναλογικό ψηφιακό σήμα ψηφιοποιείται και η παρατήρηση, αλλά και όλος ο έλεγχος και η λειτουργία του μικροσκοπίου, γίνονται μέσω Η/Υ. Τα υπόλοιπα ηλεκτρόνια ή ακτινοβολίες που παράγονται μπορούν να μας δώσουν άλλες πληροφορίες σχετικές με την υφή και σύσταση του παρασκευάσματος.
Εικόνα 3. Σχηματική παράσταση των διαφόρων τμημάτων ενός ηλεκτρονικού μικροσκοπίου σάρωσης (ΗΜΣ).

Εικόνα 4. Οι διάφοροι τρόποι αλληλοεπίδρασης παρασκευάσματος και δέσμης επιταχυνμένων ηλεκτρονίων, όπως συμβαίνει και στο ΗΜΣ.
Προετοιμασία παρασκευασμάτων για το ΗΜΣ.
Ένα παρασκεύασμα για να παρατηρηθεί με το κλασσικό ΗΜΣ θα πρέπει να έχει ορισμένες ιδιότητες που είναι:
α. να αντέχει στο υψηλό κενό,
β. να αντέχει στο βομβαρδισμό ηλεκτρονίων, και
γ. να είναι αγώγιμο.
Έχοντας αυτές τις ιδιότητες υπ' όψη μπορούμε να κρίνουμε τι επεξεργασία χρειάζεται κάποιο παρασκεύασμα ανάλογα με την υφή του. Πιο κάτω αναφέρονται μερικά χαρακτηριστικά παραδείγματα μεθόδων προετοιμασίας παρασκευασμάτων.
1. Μέταλλα: δεν απαιτείται καμιά απολύτως προετοιμασία, μπορούν να παρατηρηθούν απ' ευθείας αφού πρώτα επικολληθούν στις ειδικές βάσεις (stubs) με ειδική αγώγιμη κόλλα όπως είναι ο κολλοειδής άργυρος (silver dug) ή ο κολλοειδής άνθρακας.
2. Ορυκτά: επικόλληση σε stubs και επικάλυψη με λεπτό στρώμα μετάλλου (χρυσού), που συνήθως γίνεται με εκκένωση αίγλης σε ατμόσφαιρα αργού, για να γίνουν αγώγιμα.
3. Βιολογικά παρασκευάσματα ξερά, π.χ. γυρεόκοκκοι, φυτικά σπέρματα, ξύλο, δόντια κλπ. ακολουθείται η ίδια προετοιμασία όπως και για τα ορυκτά.
4. Βιολογικά παρασκευάσματα νωπά. Ο κλασσικός τρόπος προετοιμασίας περιλαμβάνει χημική μονιμοποίηση, συνήθως με γλουταρική αλδεΰδη και καμιά φορά και με OsO4, σε ευαίσθητα παρασκευάσματα, ακολουθεί αφυδάτωση με αλκοόλη ή ακετόνη, ξήρανση σε συσκευή κρίσιμου σημείου (critical point dryer) και στη συνέχεια όπως και στο (2). Καλύτερη μονιμοποίηση επιτυγχάνεται με τη φυσική μονιμοποίηση, όπου το παρασκεύασμα παγώνεται πολύ γρήγορα και παρατηρείται παγωμένο. Η φυσική μονιμοποίηση (κρυοτεχνική) απαιτεί ειδικές για τη διατήρηση του παρασκευάσματος σε χαμηλή θερμοκρασία κατά τη διάρκεια της παρατήρησης. Λόγω του πολύ γρήγορου παγώματος τα παρασκευάσματα υφίστανται τις λιγότερες δυνατές τεχνητές αλλοιώσεις (artefacts).
Με τη μέθοδο της φυσικής μονιμοποίησης, μπορεί να γίνει παρατήρηση σχεδόν οποιουδήποτε παρασκευάσματος όπως είναι διάφορα τρόφιμα, γαλακτώματα, σε υγρή η στερεή κατάσταση.