Κωνσταντίνος Φασσέας, Καθηγητής Γ.Π.Α.
Οι ιστοχημικές μέθοδοι εφαρμόζονται σε τομές νωπών φύλλων κομμένων με το χέρι, μερικά λεπτά από την αποκοπή τους από το φυτό, ή σε μονιμοποιημένα παρασκευάσματα σε π.χ. FAA (Formalin - Acetic Acid - Alcohol), για παρατήρηση στο οπτικό μικροσκόπιο, στο μικροσκόπιο φθορισμού ή στο στερεοσκόπιο.
Στη συνέχεια παραθέτω τις ποιό κοινές ιστοχημικές τεχνικές που εφαρμόζουμε στο Εργαστήριο μας καθώς, την αντίστοιχη βιβλιογραφία και φωτογραφίες που δείχνουν το αποτέλεσμα.
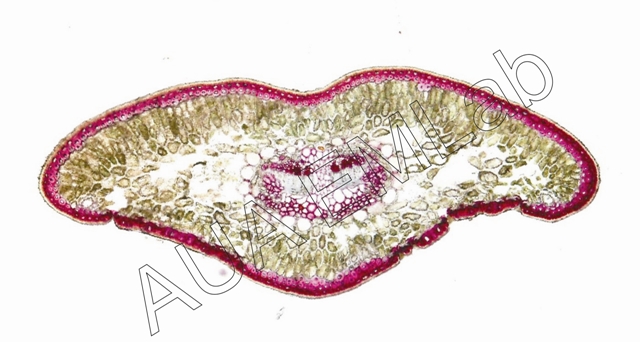
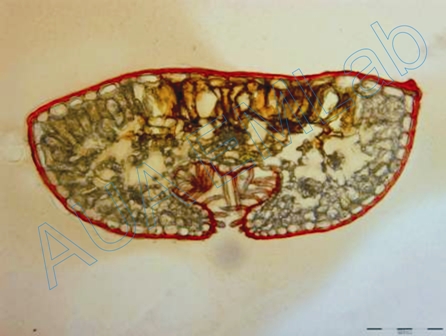
Χρησιμοποιείται για τον εντοπισμό λιγνίνης. Η αντίδραση είναι ειδική αλλά εμφανίζεται θετική και για πεντοζάνες (ημικυτταρίνες) (Davidson et al. 1995, Feder and O'Brien 1968). Τα λιγνινοποιημένα κυτταρικά τοιχώματα χρωματίζονται βυσσινί - κόκκινα - ροζ.
Τοποθετούμε την τομή νωπή ή μονιμοποιημένη, σε φλωρογλυκίνη (1% σε 95% αιθανόλη). Στο πλάι της καλυπτρίδας βάζουμε μια σταγόνα 25% HCl. Η διάχυση του HCl, διευκολύνεται, τοποθετώντας ένα κομμάτι διηθητικού χαρτιού από την απέναντι πλευρά της καλυπτρίδας.

Εγκάρσια τομή φύλλου γυμνόσπερμου φυτού. Η αντίδραση της φλωρογλυκίνης μας δείχνει τα λιγνινοποιημένα κύτταρα. (Φωτ. Κ. Φασσέας).
Το αντιδραστήριο χρησιμοποιείται για τον εντοπισμό τερπενοειδών, τα οποία και αποκτούν χρώμα ιώδες-βιολετί. Το διάλυμα παρασκευάζεται ακριβώς πριν χρησιμοποιηθεί. Επειδή είναι φωτοευαίσθητο διατηρείται σε σκουρόχρωμο μπουκαλάκι και η χρώση των τομών γίνεται στο σκοτάδι (Pasqua et al. 2003).
Για την παρασκευή του διαλύματος αναμιγνύονται 0,5 ml από 1% a-naphtol σε 40% αλκοόλη, με 0,5 ml από 1% Ν,Ν-dimethyl-p-phenylenediamine monohydrochloride σε αποσταγμένο νερό, και με 49 ml φωσφορικού ρυθμιστικού διαλύματος 0,05 Μ (pH 7,2).
Οι τομές παραμένουν στο αντιδραστήριο για 1 h.
Η παρατήρηση γίνεται σε γλυκερόλη στο Ο.Μ..
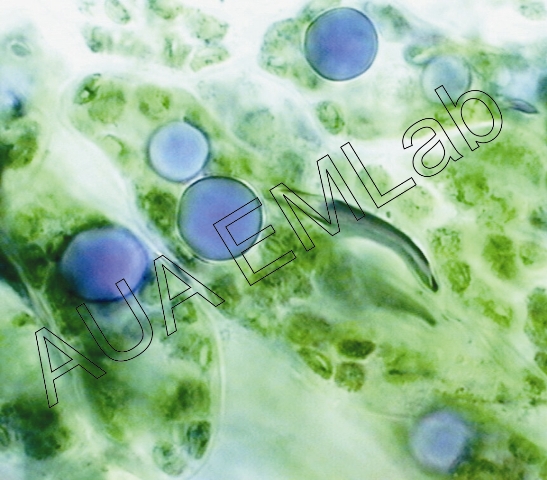

Κύτταρα από το μεσόφυλλο αρωματικού φυτού που περιέχουν σταγονίδια τερπενοειδούς φύσης. Η δεύτερη εικόνα δείχνει ρητίνη μέσα σε ρητινοφόρο αγωγό φύλλου γυμνόσπερμου φυτού. (Φωτ. Χ. Γκιάφη, Κ. Φασσέας).
Το αντιδραστήριο χρησιμοποιείται για τον εντοπισμό λιπιδίων, κουτίνης και σουβερίνης, εκτός των φωσφορολιπιδίων, τα οποία και χρωματίζονται κόκκινα. Η αντίδραση στηρίζεται στην επιλεκτική διαλυτότητα της χρωστικής στα λιπίδια. Πιο συγκεκριμένα η χρωστική ειναι πιο διαλυτή στα λιπίδια του ιστού από ότι στον διαλύτη, στον οποίο αρχικά διαλύθηκε (εδώ στην αλκοόλη), και έτσι με την απλή τοποθέτηση του ιστού στη χρωστική, τα λιπίδια την προσλαμβάνουν. Η αποτελεσματικότητα της αντίδρασης στηρίζεται σε πολλούς παράγοντες ανάμεσα στους οποίους και η φυσική κατάσταση των λιπιδίων. Γενικά, η αντίδραση για τα έλαια είναι πολύ πιο αποτελεσματική από ότι για τα λίπη, τα οποία και παρουσιάζουν ασθενή αντίδραση (Jensen 1962).
Επειδή χρησιμοποιείται διάλυμα σε αλκοόλη απαιτείται ιδιαίτερη προσοχή στην διατήρηση των χρόνων, διότι η αλκοόλη είναι διαλύτης των λιπών και μπορεί να δημιουργηθούν προβλήματα από την μεγάλη παραμονή τους στο διάλυμα (Johansen 1940).
Μπορεί να χρησιμοποιηθεί κορεσμένο διάλυμα σε αλκοόλη:
Οι τομές εμβαπτίζονται στο διάλυμα για 5 min.
Ακολουθεί γρήγορη έκπλυση σε απόλυτη αλκοόλη.
Τέλος, παρατήρηση σε 25% γλυκερόλη στο Ο.Μ.
Είτε μπορεί να χρησιμοποιηθεί 0,5% Sudan IV σε 85% αλκοόλη:
Οι τομές εμβαπτίζονται στο διάλυμα για 2-5 min.
Ακολουθεί γρήγορη έκπλυση σε 50% αλκοόλη.
Τέλος, παρατήρηση σε γλυκερόλη στο Ο.Μ.
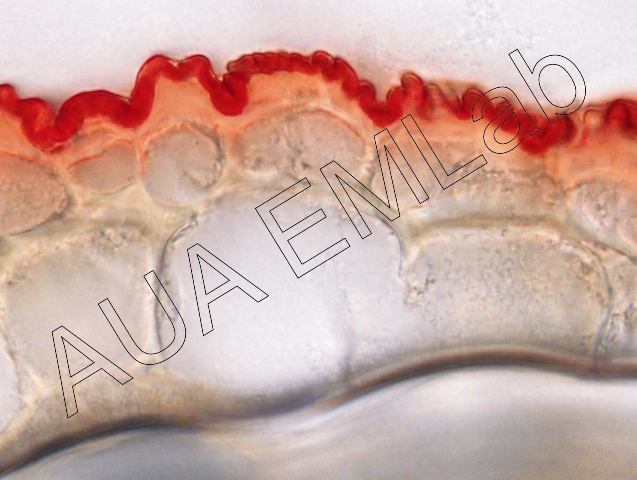
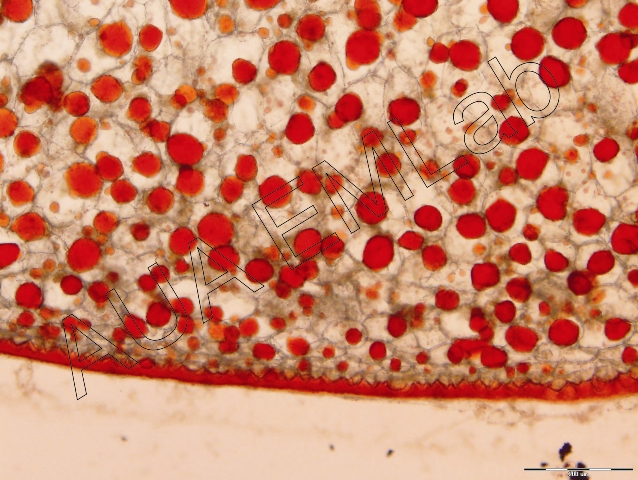
Στην πρώτη και τρίτη εικόνα έχει χρωματιστεί η εφυμενίδα φύλλων ενώ στη δεύτερη εκτός από την εφυμενίδα έχουν χρωματιστεί και τα ελαιοσταγονίδια του περικαρπίου γνωστού ελαιοφόρου καρπού. (Φωτ. Κ. Μιχαλίτσης, Β. Ψαροκωστοπούλου, Κ. Φασσέας).
Το διάλυμα Sudan Black B χρησιμοποιείται για τον εντοπισμό λιπιδίων σε μονιμοποιημένα παρασκευάσματα (Bronner 1975) και σε νωπές τομές. Τα λιπίδια και στις δύο περιπτώσεις βάφονται μαύρα. Ό,τι ισχύει για το Sudan IV, ισχύει και για το Sudan Black B, εκτός του ότι χρωματίζει όλα τα λιπίδια, συμπεριλαμβανομένων και των φωσφορολιπιδίων (Jensen 1962).
Για τα μονιμοποιημένα παρασκευάσματα:
Παρασκευάζεται φρέσκο κορεσμένο διάλυμα Sudan Black B σε 70% αιθανόλη (περίπου 0,3% Sudan Black B). Το διάλυμα διατηρείται σε κλειστό δοχείο για 12 h στους 37°C.
Ακολουθεί φιλτράρισμα.
Στη συνέχεια το διάλυμα τοποθετείται για 30 min στους 60°C.
Η προετοιμασία των δειγμάτων είναι η ίδια με εκείνη που ακολουθήθηκε και για την προετοιμασία τους για το οπτικό μικροσκόπιο και το ηλεκτρονικό μικροσκόπιο διέλευσης. Η τμήση των τομών έγινε με τον ίδιο τρόπο όπως και για το Ο.Μ. μέχρι το σημείο που η αντικειμενοφόρος με τις τομές τοποθετείται στη θερμαινόμενη πλάκα.
Οι τομές ήταν πάχους 0,6 μm.
Οι τομές χρησιμοποιούνται στη συνέχεια για τη χρώση χωρίς να απομακρυνθεί η ρητίνη.
Τοποθετούνται σε 70% αιθανόλη για 1-2 min.
Ακολουθεί χρώση με το διάλυμα Sudan Black B για 1 h στους 60°C .
Τέλος οι τομές ξεπλένονται με 70% αιθανόλη για 1 min, με νερό και παρατηρούνται με το Ο.Μ. σε σταγόνα γλυκερόλης.
Για νωπές τομές:
Οι τομές τοποθετούνται σε 50% αιθανόλη για λίγα λεπτά.
Στη συνέχεια τοποθετούνται σε κορεσμένο και φιλτραρισμένο διάλυμα Sudan Black B σε 70% αιθανόλη για 5-20 min.
Έκπλυση σε 50% αιθανόλη για 1 min.
Τέλος, παρατήρηση σε γλυκερόλη στο Ο.Μ.

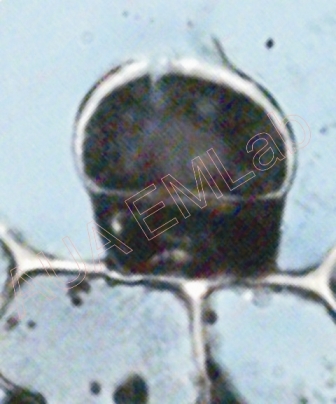
Αδενώδει τρίχες αρωματικού φυτού. Η πρώτη εικόνα είναι από νωπό παρασκεύασμα και η δεύτερη από μονιμοποιημένο και εγκλεισμένο σε εποξική ρητίνη (επεξεργασία για Ηλεκτρονικό Μικροσκόπιο Διέλευσης). (Φωτ. Α. Αργυροπούλου)
Χρησιμοποιείται για τον εντοπισμό συνολικών λιπιδίων με το μικροσκόπιο φθορισμού. Τα λιπίδια εκπέμπουν μπλε-πράσινο φθορισμό ή κίτρινο ανάλογα με τη σύνθεσή τους (Clark 1981).
Παρασκευάζεται υδατικό διάλυμα 0,1% Neutral Red με pH 6,5.
1 σταγόνα από το διάλυμα προστίθεται σε μία σταγόνα θαλασσινού νερού και οι τομές τοποθετούνται στο αντιδραστήριο.
Ακολουθεί άμεση παρατήρηση στο μικροσκόπιο φθορισμού.
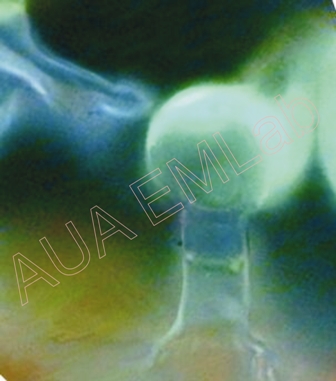
Αδενώδης τρίχα αρωματικού φυτού. Παρατηρείται έντονος φθορισμός των εκκριμάτων και των κυτταρικών τοιχωμάτων του κάτω κυττάρου της βάσης (λόγω της κουτίνης). (Φωτ. Χ. Γκιάφη).
Το αντιδραστήριο χρησιμοποιείται για τον in vivo εντοπισμό φαινολών σε φυτικό υλικό και πιο συγκεκριμένα μονοτερπενικών φαινολών. Βασίζεται στην αντίδραση συμπύκνωσης των φαινολών με την 4-νιτροσοφαινόλη παρουσία πυκνού οξέως κατά την οποία παράγονται χρωματισμένες ινδοφαινόλες και νερό. Σε περίπτωση θετικής αντίδρασης το χρώμα της παραγόμενης ινδοφαινόλης είναι ενδεικτικό, όχι όμως και οριστικό, της αρχικής μονοτερπενικής φαινόλης, αφού περισσότερες από μία φαινόλες μπορούν να δώσουν το ίδιο χρώμα. π.χ. η θυμόλη δίνει κόκκινο και η καρβακρόλη πράσινο χρώμα ινδοφαινόλης (βλέπε σχήμα) (Gersbach et al. 2001).
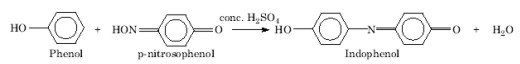
0,05% 4-νιτροσοφαινόλη σε π. Η2SO4.
Μερικές σταγόνες αντιδραστηρίου προστίθενται στην επιφάνεια, προσαξονική και αποαξονική, του φύλλου (στην οποία εντοπίζονται οι αδένες).
Η περίσσεια του αντιδραστηρίου αναρροφάται με διηθητικό χαρτί από την επιφάνεια του φύλλου για να καταστεί δυνατή η φωτογράφηση χωρίς έντονες ανακλάσεις του φωτός.
Η παρατήρηση των όποιων αλλαγών στο χρώμα γίνεται αμέσως με στερεοσκόπιο.
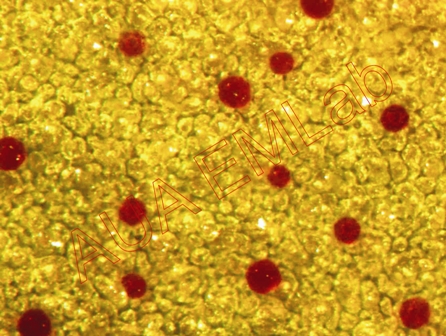
Οι κεφαλές των αδενωδών τριχωμάτων έχουν χρωματιστεί κόκκινες λόγω του ότι περιέχουν τη μονοτερπενική φαινόλη θυμόλη. (Φωτ. Κ. Μιχαλίτσης).
Το αντιδραστήριο Wagner χρησιμοποιείται για την ανίχνευση αλκαλοειδών, αφού σχηματίζει μαζί τους καστανόχρωμα ιζήματα (Furr and Mahlberg 1981).
1,25 g κρυσταλλικού ιωδίου και 2 g ιωδιούχου καλίου σε 100 ml απεσταγμένου νερού (ανάδευση για αρκετή ώρα)
Η παρατήρηση γίνεται μετά από λίγα λεπτά σε σταγόνα νερού στο Ο.Μ..
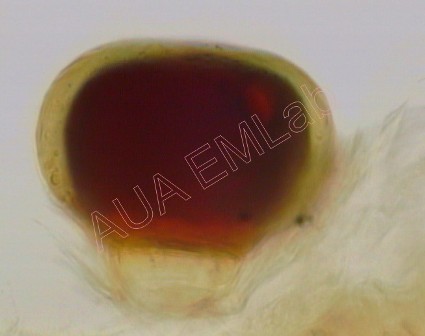
Το καστανό χρώμα δείχνει ότι το αδενώδες τρίχωμα του αρωματικού αυτού φυτού συσσωρεύει αλκαλοειδείς ουσίες. (Φωτ. Α. Αργυροπούλου).
Το αντιδραστήριο Ellram χρησιμοποιείται στον εντοπισμό αλκαλοειδών με τα οποία δίνει χρωστικές αντιδράσεις (παρατηρείται κόκκινο χρώμα) (Furr and Mahlberg 1981).
1 g βανιλλίνης προστίθεται σε 100 g 40% θειικού οξέος (ανάδευση για αρκετή ώρα)
Η παρατήρηση γίνεται μετά από λίγα λεπτά σε σταγόνα νερού στο Ο.Μ..
Οι συμπυκνωμένες ταννίνες μπορούν να εντοπιστούν σε νωπές τομές σε κορεσμένο διάλυμα αλκοολικής βανιλλίνης. Σε περίπτωση παρουσίας τους ένα έντονο κόκκινο χρώμα εμφανίζεται αμέσως. Ιδιαίτερη προσοχή χρειάζεται με τα ξυραφάκια με τα οποία γίνονται οι τομές, ώστε να είναι καθαρά, διότι σε περίπτωση που είναι από σίδηρο, μπορεί το υλικό να αντιδράσει με τις φαινόλες του δείγματος και να αναπτυχθεί χρώμα κατά τη διάρκεια των τομών (Gardner 1975).
To αντιδραστήριο παρασκευάζεται προσθέτοντας 2 όγκους 10% (w/v) βανιλλίνης-αιθυλικής αλκοόλης σε 1 όγκο πυκνού HCl και απευθείας τοποθέτηση των τομών (Sarkar and Howarth 1976).
Εναλλακτικά, παρασκευάζεται κορεσμένο διάλυμα βανιλλίνης σε αιθυλική αλκοόλη (Gardner 1975). Οι τομές τοποθετούνται αμέσως σε μία σταγόνα του διαλύματος. Στη συνέχεια προστίθενται αρκετές σταγόνες πυκνού HCl.
Τέλος, η παρατήρηση γίνεται σε γλυκερόλη στο Ο.Μ..
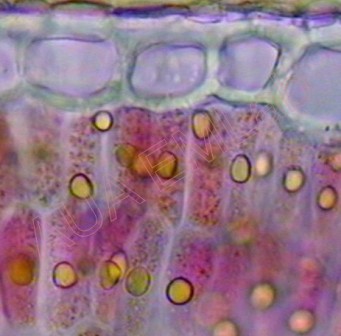
Εντοπισμός ταννινών (κόκκινο-ροζ) σε κύτταρα πασσαλώδους παρεγχύματος αρωματικού φυτού. (Φωτ. Χ. Γκιάφη)
Για τον εντοπισμό τανινών μπορεί να χρησιμοποιηθεί διάλυμα FeSO4, με το οποίο οι τανίνες παίρνουν χρώμα πορτοκαλί εώς μαύρο (Clark 1981, Johansen 1940).
Το αντιδραστήριο προκύπτει από την προσθήκη 0,25 ml παγόμορφου οξικού οξέως, 10 ml 37% φορμαλδεΰδης και 2 g FeSO4 σε 89 ml αποσταγμένου νερού.
Οι τομές κόβονται σε νερό.
Στη συνέχεια τοποθετούνται στο αντιδραστήριο όπου και παραμένουν 2-4 h ή και 18 h.
Τέλος η παρατήρηση γίνεται σε γλυκερόλη στο Ο.Μ..
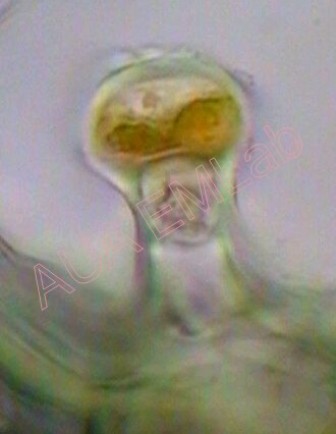
Εντοπισμός τανινών στην κεφαλή αδενώδους τριχώματος αρωματικού φυτού. (Φωτ. Χ. Γκιάφη)
Το αντιδραστήριο χρησιμοποιείται για τον εντοπισμό φαινολικών ενώσεων, οι οποίες αποκτούν χρώμα κόκκινο ή καφέ (Alaimo et al. 2000).
Ετοιμάζεται διάλυμα 0,08% Fast Blue BB Salt σε οξικό ρυθμιστικό. Το ρυθμιστικό προκύπτει από 0,2 Μ Οξικού νατρίου, στο οποίο το pH έχει ρυθμιστεί στο 7,0-7,2, όσο δηλαδή και των φυτικών κυττάρων, με 0,2 Μ Οξικού οξέος.
Οι νωπές τομές τοποθετούνται για 30 min στο αντιδραστήριο, σε θερμοκρασία δωματίου.
Ακολουθεί απ’ευθείας παρατήρηση.

Το διχρωμικό κάλιο εντοπίζει φαινολικές ενώσεις οι οποίες και χρωματίζονται σκούρο καφέ.
(http://dbv.fc.ul.pt/HistCit/protocolos.pdf).
Τομές φρέσκου δείγματος τοποθετούνται σε διάλυμα διχρωμικού καλίου 10% σε νερό, για 10 min.
Ακολουθεί γρήγορο ξέπλυμα με νερό.
Παρατήρηση σε σταγόνα νερού στο Ο.Μ.
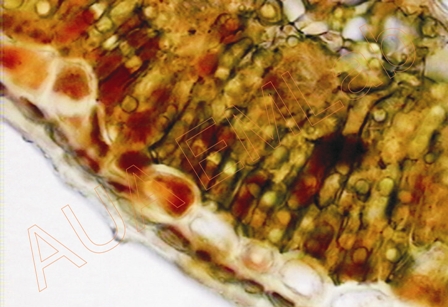
Οι καφέ κηλίδες είναι οι φαινολικές ενώσεις στα κύτταρα των διαφόρων ιστών. (Φωτ. Χ. Γκιάφη).
Το διάλυμα αυτό χρησιμοποιείται στον εντοπισμό φλαβονών (flavones), φλαβονολών (flavonols) και φλαβανονών (flavanones) με το μικροσκόπιο φθορισμού. Ο φθορισμός που προκύπτει είναι πρασινοκίτρινος για τις φλαβόνες, κίτρινος για τις φλαβονόλες και μπλε για τις φλαβανόνες. Το διάλυμα παρασκευάζεται είτε με νερό είτε με αιθυλική αλκοόλη, το αποτέλεσμα είναι το ίδιο (Guerin et al. 1971)
Το διάλυμα προκύπτει με διάλυση 5% χλωριούχου αργιλίου σε νερό ή σε αιθυλική αλκοόλη.
Οι τομές τοποθετούνται σε λίγες σταγόνες διαλύματος.
Τέλος, γίνεται άμεση παρατήρηση σε μικροσκόπιο φθορισμού.

Ο πρασινοκίτριν0ος φθορισμός δείχνει τη θέση των φλαβονών και φλαβανολών ενώ ο μπλέ, στα κύτταρα του πασσαλώδους παρεγχύματος δείχνει τη θέση των φλαβανονών. Ο κόκκινος φθορισμός οφείλεται στην παρουσία χλωροφύλλης. Ο φωτεινός γαλάζιος φθορισμός οφείλεται στην παρουσία λιγνίνης σε σκληρεγχυματικά κύτταρα. (Φωτ. Κ. Φασσέας).
Χρησιμοποιείται για τον εντοπισμό πολυσακχαριτών, πλην της κυτταρίνης, οι οποίοι εμφανίζονται ρoζ εώς κόκκινοι (Jensen 1962).
Παρασκευάζεται διάλυμα 0,05% ερυθρού του ρουθηνίου σε νερό, στο οποίο και τοποθετούνται οι τομές.
Οι τομές παραμένουν στο διάλυμα για 1-5 min.
Ακολουθεί παρατήρηση σε νερό με το Ο.Μ.
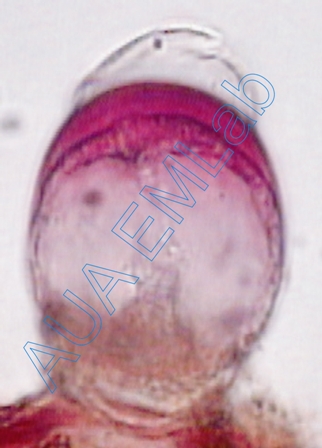
Το ροζ-κόκκινο χρώμα δηλώνει την παρουσία πολυσακχαριτών (εκτός της κυτταρίνης). (Φωτ. Α. Αργυροπούλου).
ΒΙΒΛΙΟΓΡΑΦΙΑ
Alaimo, M. G., Dongarrà, G., Melati, M. R., Monna, F. and Varrica, D. (2000). Recognition of environmental trace metal contamination using pine needles as bioindicators. The urban area of Palermo (Italy). Environmental Geology 39(8), 914-924.
Bronner, R. (1975). Simultaneous demonstration of lipids and starch in plant tissues. Stain Technology 50(1), 1-4.
Clark, G. (1981). Staining Procedures. 4th Edition. Williams and Wilkins.
Davidson, R.S., Choudhury, H., Origgi, S., Castellan, A., Trichet, V. and Capretti, G. (1995). The reaction of phloroglucinol in the presence of acid with lignin-containing materials. Journal of Photochemistry and Photobiology A: Chemistry 91 pp.87-93.
Feder, N. and O'Brien, T.P. (1968). Plant Microtechnique. Some principles and new methods. American Journal of Botany 55 (1) pp.123-142.
Furr, M. and Mahlberg P. G. (1981). Histochemical analyses of laticifers and glandular trichomes in Cannabis sativa. Journal of Natural Products 44(2), 153-159.
Gardner, R. O. (1975). Vanillin-hydrochloric acid as a histochemical test for tannin. Stain Technology 50(5), 315-317.
Gersbach, P. V., Wyllie, S. G. and Sarafis, V. (2001). A New Histochemical Method for Localization of the Site of Monoterpene Phenol Accumulation in Plant Secretory Structures. Annals of Botany 88, 521-525.
Guerin, H. P., Delaveau, P. G. and Paris, R. R. (1971). Localisations histochimiques. II: Procédés simples de localization de pigments flavoniques. Application à quelques Phanérogrames. Bulletin de la Societe Botanique de France 118, 29-36.
Jensen, W.A. (1962). Botanical Histochemistry_Principles and Practice. 1rst Edition. W.H. Freeman and Company.
Pasqua, G., Monacelli, B. and Silvestrini, A. (2003). Accumulation of essential oils in relation to root differentiation in Angelica archangelica L. European Journal of Histochemistry 47(1), 87-90.
Sarkar, S. K. and Howarth, R. E. (1976). Specificity of the Vanillin Test for Flavanols. Journal of Agricultural and Food Chemistry 24(2), 317-320.