ΜΟΡΙΑΚΗ ΑΝΑΓΝΩΡΙΣΗ
ΕΡΓΑΣΤΗΡΙΑ
Άσκηση 1η
Μοριακά μοντέλα πεπτιδίων και
δευτεροταγής δομή.
Εισαγωγή.
Οι πρωτείνες συντίθενται από μακριές
πολυμερικές αλυσίδες από αμινοξέα. Τα πολυπεπτίδια αυτά διαφέρουν από τα άλλα
πολυμερή (πολυσακχαρίτες, πολυουρεθάνια κλπ.) γιατί αποτελούνται από
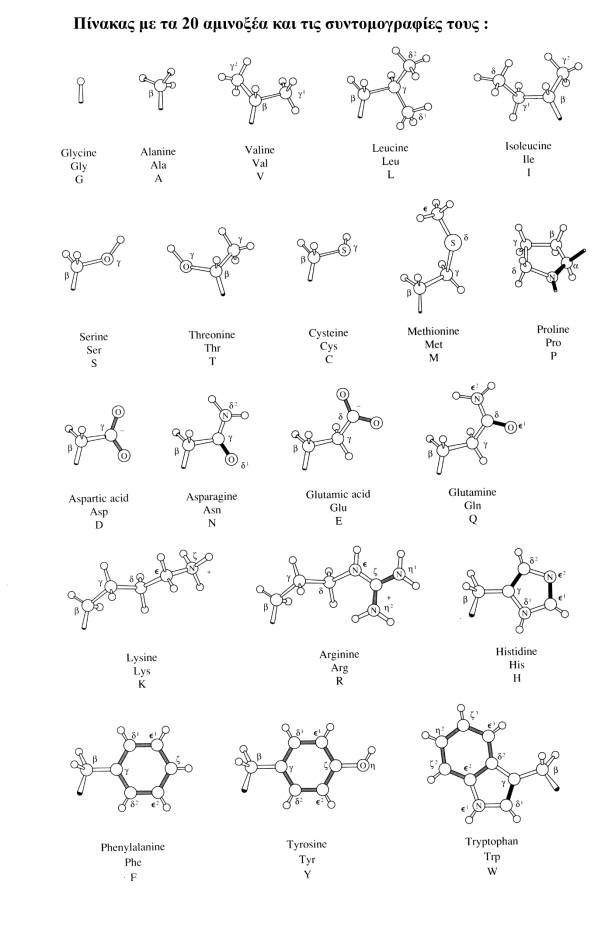
αναρίθμητους συνδυασμούς των είκοσι L-αμινοξέων που διαφέρουν και ως προς το
μέγεθός τους αλλά και ως προς τις ιδιότητες τους. Είναι αυτή η ποικιλία που
κάνει τα πολυπεπτίδια χρήσιμα και λειτουργικά. Για μία πολύ μικρή πρωτείνη όπως
η ινσουλίνη με 58 αμινοξέα υπάρχουν 2058 δυνατές συνθέσεις και πολλές
περισσότερες δυνατές στερεοδομές, μιά που κάθε αμινοξύ έχει δύο τουλάχιστον
βαθμούς ελευθερίας. Η ιδιαιτερότητα των δομικών μονάδων των πρωτεινών οφείλεται
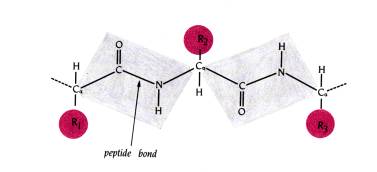
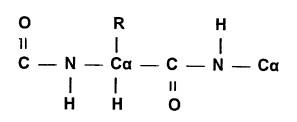
στον δεσμό σύνδεσης μεταξύ των αμινοξέων -OC--ΝΗ- , τον πεπτιδικό δεσμό. Ο
πεπτιδικός δεσμός, κάτι μεταξύ απλού και διπλού δεσμού δημιουργείται με την
κατανομή του ηλεκτρονικού φορτίου
μεταξύ της CO και ΝΗ ομάδος, δημιουργώντας μία επίπεδη ομάδα έξη ατόμων
με υψηλό ενεργειακό φράγμα περιστροφής
(21 kcal/mol) γύρω από τον δεσμό C-Ν που έχει μήκος 1.325 Α.
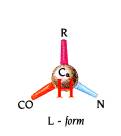
Η θέση της πλευρικής αλυσίδας στον ασύμμετρο άλφα άνθρακα του αμινοξέως είναι επίσης .μοναδική για
τα φυσικά αμινοξέα και είναι τέτοια ώστε όταν κοιτάζουμε τον α-άνθρακα από το
υδρογόνο, οι τρεις ομάδες που συναντούμε κατά την φορά των δεικτών του ρολογιού
να σχηματίζουν την λέξη CO-R-Ν, όπου R η πλευρική αλυσίδα.
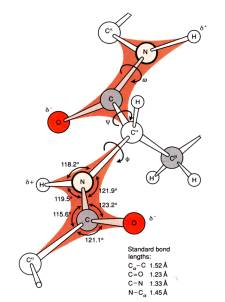
Οι δύο βαθμοί ελευθερίας της κυρίας αλυσίδας κάθε πεπτιδίου είναι οι περιστροφές γύρω από τους
απλούς δεσμούς Ν-Ca και Ca-C. Η ονοματολογία για τις δίεδρες γωνίες γύρω από αυτούς τους δεσμούς είναι Φ
και Ψ αντίστοιχα. Λόγω της τοποθέτησης των ομάδων CO, ΝΗ και της πλευρικής αλυσίδας οι δύο αυτές
γωνίες δεν μπορούν να πάρουν όλες τις τιμές. Οι περιορισμοί μπορούν να δοθούν σε ένα διάγραμμα γωνιών που
λέγεται Ramachandran plot.
Σκοπός της Άσκησης.
Ο σκοπός της άσκησης αυτής είναι η κατανόηση των δομικών
χαρακτηριστικών των αμινοξέων (πεπτιδικός δεσμός, βαθμοί ελευθερίας,
L-υποκατάσταση) και των στερεοδιατάξεων που είναι δυνατόν ένα αμινοξύ να
βρεθεί. Επίσης είναι η αναγνώριση των βασικών χημικών ομάδων, κυρίων και
πλευρικών και των μεταξύ των αλληλεπιδράσεων.
Μεθοδολογία.
l. Κατασκευάστε το διπεπτίδιο Αλανίνη-Αλανίνη όπως αυτό δίνεται
στο διάγραμμα. Λάβετε υπ' όψιν σας τα μήκη των δεσμών, την στερεοδιάταξη των
ατόμων και το χρώμα τους. Τα χρώματα που χρησιμοποιούνται για την διαφοροποίηση
των ατόμων είναι :
κόκκινο για το οξυγόνο
μαύρο για τον άνΘρακα
μπλέ για το άζωτο
άσπρο για το υδρογόνο
κίτρινο για το Θείο και
μωβ για τον φώσφορο.
2. Αναγνωρίστε τις δίεδρες Φ,Ψ και εξηγήστε τις επιτρεπτές και μή
θέσεις του Ramachandran plot.
3. Προσθέστε άλλες πλευρικές αλυσίδες (Βαλίνη, Θρεονίνη, Σερίνη)
και βρείτε και άλλους στερεοδιατακτικούς περιορισμούς του διαγράμματος. Υπάρχει
δυνατότητα αλληλεπίδρασης της πλευρικής αλυσίδας με την κυρία αλυσίδα;
4. Ανά ζεύγη δώστε την κατάλληλη στερεοδιάταξη (Φ,Ψ) στα
διπεπτίδια σας και κατασκευάστε παράλληλες και αντιπαράλληλες β-πτυχωτές
επιφάνειες. Εντοπίστε τους υδρογονικούς δεσμούς.
5. Ανά ζεύγη κατασκευάστε μία στροφή α-έλικας και εντοπίστε τυχόν
υδρογονικούς δεσμούς.
Γράψτε το πείραμα και τις παρατηρήσεις σας για την επόμενη φορά.
Μετά την λήξη του εργαστηρίου παρακαλώ διαλύστε τα μοντέλλα με
προσοχή και βάλτε τα στο κουτί τους προσέχοντας να μην χαθεί κανένα άτομο. Κάθε
κουτί περιέχει:
15 δεσμούς,
5 άνθρακες sp3 (τετραεδρικούς) ,
2 ανθρακες sp2 (επίπεδους),
2 άζωτα ,
3 οξυγόνα και
4 υδρογόνα.
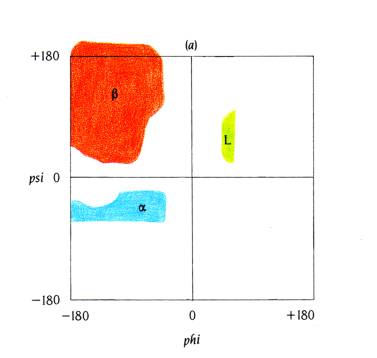
Διάγραμμα Ramachadran (
phi , psi ) :